CDE发布《体内基因治疗产品药学研究与评价技术指导原则(试行)》等3个指导原则
所属分类: 行业动态
发布时间:2022-06-15
2022年5月31日,国家药品监督管理局药品审评中心(CDE)连发三条药学指导原则:《体外基因修饰系统药学研究与评价技术指导原则(试行)》、《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》、《体内基因治疗产品药学研究与评价技术指导原则(试行)》,均自发布之日起施行(2022年5月26日)。
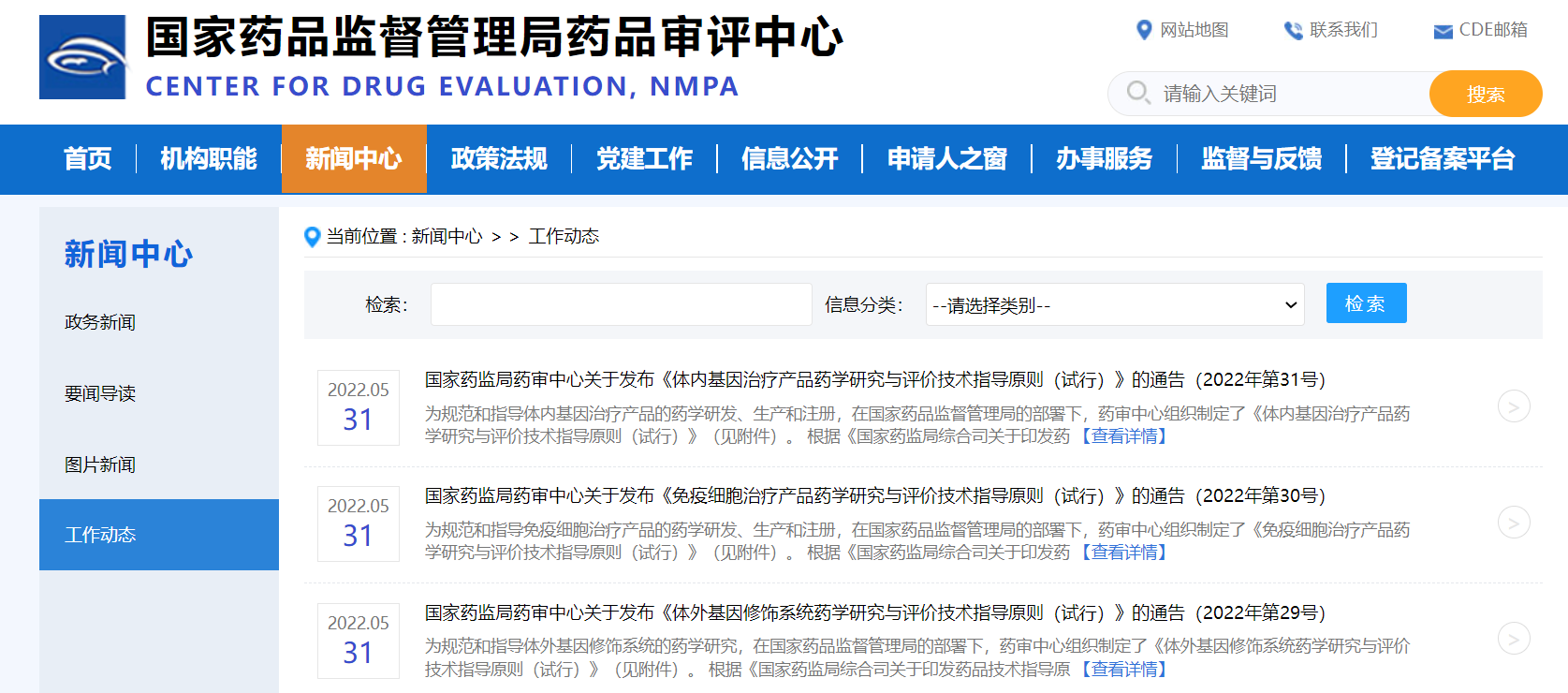


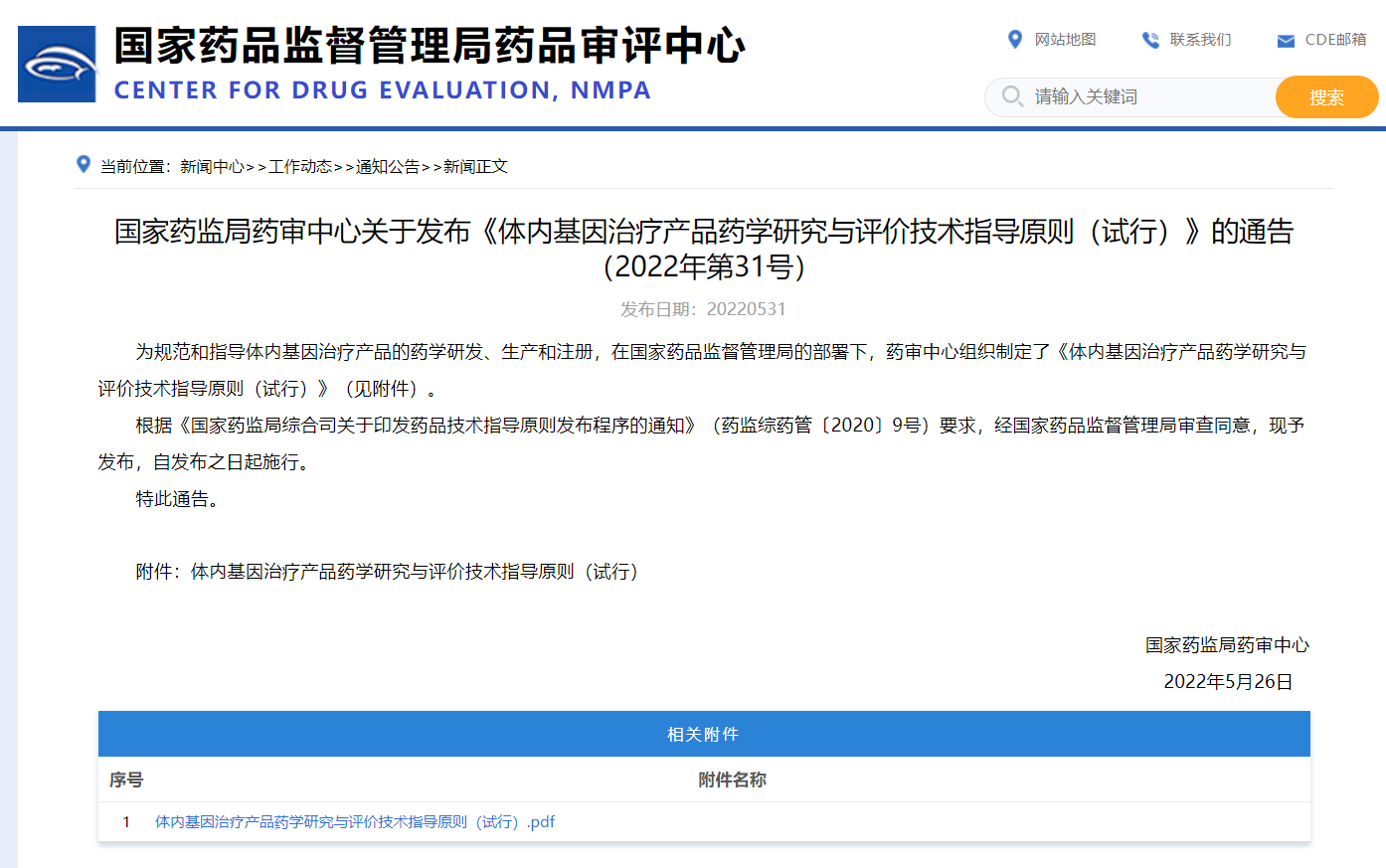
相关附件:
1、《体外基因修饰系统药学研究与评价技术指导原则(试行)》全文下载:https://www.cde.org.cn/main/news/viewInfoCommon/6f14372f020446361601bb074a09410d
2、《免疫细胞治疗产品药学研究与评价技术指导原则(试行)》全文下载:https://www.cde.org.cn/main/news/viewInfoCommon/0584963a84e01bb4d83022f559d22144
3、《体内基因治疗产品药学研究与评价技术指导原则(试行)》全文下载:https://www.cde.org.cn/main/news/viewInfoCommon/c0ec5e347ba84df67bf75e15f6ad3f3f
关键词: CDE发布《体内基因治疗产品药学研究与评价技术指导原则(试行)》等3个指导原则
下一条: 暂无信息!
相关
联系我们
推广电话:18008049388(梁经理) 、19113519820
公司邮箱: Chamray@crcdmo.com
公司地址:
成都双流区慧谷东一路天府国际生物城C1栋7楼
成都市双流区慧谷东二路天府国际生物城D1栋3楼16/17单元

官方微信公众号


